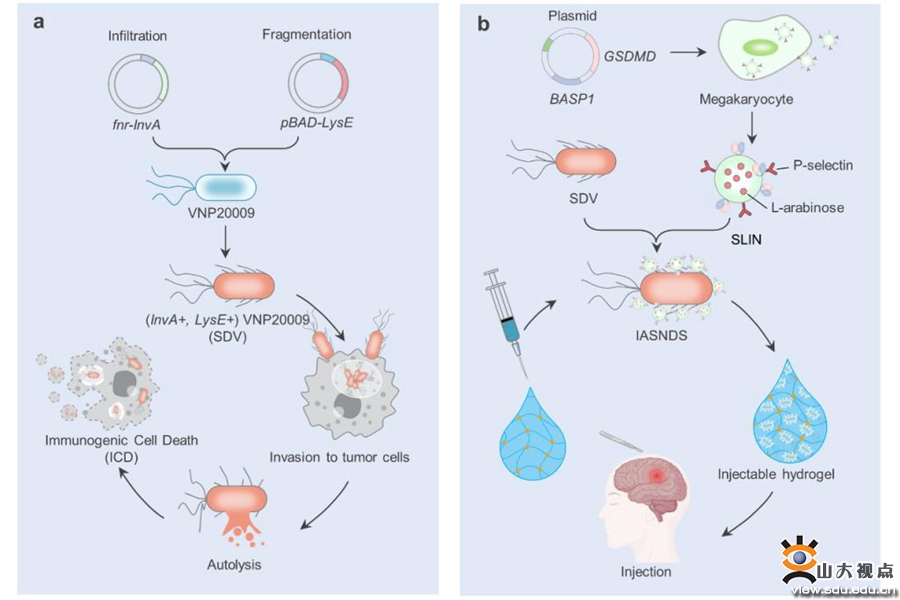
多形性膠質(zhì)母細(xì)胞瘤(GBM)是最具侵襲性、最常見的腦惡性腫瘤,患者接受手術(shù)后放療和化療預(yù)后不佳。手術(shù)切除腫瘤未能解決其高度浸潤性,腫瘤微衛(wèi)星灶處于免疫監(jiān)視受損的環(huán)境中,最終誘導(dǎo)腫瘤復(fù)發(fā),通過增強(qiáng)抗腫瘤免疫反應(yīng)來監(jiān)視和清除手術(shù)后殘留的腫瘤細(xì)胞對于抑制GBM復(fù)發(fā)至關(guān)重要。倪石磊課題組構(gòu)建了一種免疫刺激性自裂解沙門氏菌—納米膠囊輸送系統(tǒng),將誘導(dǎo)沙門氏菌裂解的納米膠囊(SLIN)修飾在鼠傷寒沙門氏菌VNP20009遞送載體(SDV)表面,構(gòu)建了一種刺激免疫的自溶性沙門氏菌納米膠囊遞送系統(tǒng)(IASNDS)。通過ATP響應(yīng)性水凝膠將IASND遞送到手術(shù)腔中,并協(xié)同增強(qiáng)免疫激活。水凝膠遞送的IASNDS可通過釋放SDV內(nèi)的細(xì)菌成分來激活先天免疫反應(yīng)并重塑GBM免疫微環(huán)境,同時(shí)增強(qiáng)吞噬作用和抗原呈遞,從而激活適應(yīng)性免疫反應(yīng)。
圖2 膠質(zhì)瘤局部自裂解細(xì)菌水凝膠治療示意圖
這項(xiàng)研究在國際上首次提出應(yīng)用“活”細(xì)菌載體治療GBM,Nature Communications編委認(rèn)為“該創(chuàng)新療法具有替代現(xiàn)階段常規(guī)放療和化療的巨大潛力(The work has great implications for the treatment of GBM as it incorporates an innovative strategy that can replace radiation and chemotherapy)”。本研究采用阿拉伯糖誘導(dǎo)活菌自裂解的策略提高了細(xì)菌治療顱內(nèi)腫瘤的安全性,使80%以上的顱內(nèi)原位荷瘤小鼠生存期延長超過90天。研究成果以“Stimulation of Tumoricidal Immunity via Bacteriotherapy Inhibits Glioblastoma Relapse”為題發(fā)表于Nature Communications(中科院1區(qū),IF:16.6)。齊魯醫(yī)院神經(jīng)外科張玉霖、研究生席開顏為第一作者,倪石磊教授為該論文的最后共同通訊作者,山東大學(xué)齊魯醫(yī)院為第一作者和通訊作者單位。
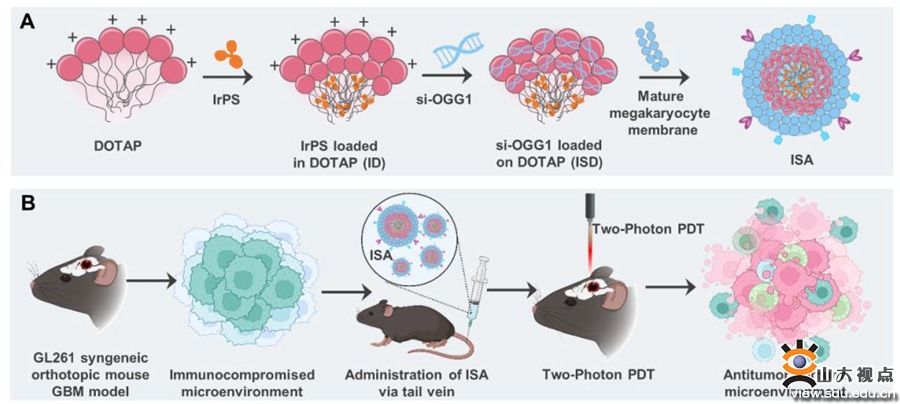
圖4 納米藥物穿過血腦屏障治療膠質(zhì)母細(xì)胞瘤示意圖
血腦屏障的存在導(dǎo)致藥物難以通過靜脈注射到達(dá)顱內(nèi),嚴(yán)重制約了抗膠質(zhì)瘤藥物的開發(fā)與應(yīng)用。倪石磊課題組設(shè)計(jì)研發(fā)了可穿過血腦屏障的“三級靶向”納米藥物ISA,該藥物表面包裹過表達(dá)P-selectin和ApoE的工程化巨核細(xì)胞膜,可實(shí)現(xiàn)穿過血腦屏障的同時(shí)靶向GBM細(xì)胞。此外,在納米顆粒內(nèi)部負(fù)載的由課題組自主合成的銥化合物(IrPS),能夠在細(xì)胞內(nèi)釋放并靶向腫瘤細(xì)胞線粒體,干擾線粒體電子傳遞鏈的正常功能,聯(lián)合搭載的核酸藥物共同誘導(dǎo)腫瘤細(xì)胞焦亡,激活抗腫瘤免疫殺傷腫瘤細(xì)胞。這種通過工程化生物膜修飾納米藥物的方式實(shí)現(xiàn)了GBM治療的三級靶向(顱腦-腫瘤-線粒體),為顱內(nèi)藥物的穿血腦屏障遞送提供了理論支撐和實(shí)踐檢驗(yàn)。研究成果以“Blood–Brain Barrier Penetrating Nanovehicles for Interfering with Mitochondrial Electron Flow in Glioblastoma”為題發(fā)表于ACS Nano(中科院1區(qū),IF:17.1)。齊魯醫(yī)院神經(jīng)外科張玉霖、研究生席開顏為本文第一作者,倪石磊教授為該論文最后共同通訊作者,山東大學(xué)齊魯醫(yī)院為第一作者和通訊作者單位。
上述研究得到了國家自然科學(xué)基金面上項(xiàng)目、國家自然科學(xué)基金國際合作項(xiàng)目、山東省重大基礎(chǔ)研究、山東省泰山學(xué)者特聘專家經(jīng)費(fèi)等項(xiàng)目的資助。
【供稿單位:齊魯醫(yī)院 作者:張玉霖 編輯:新聞網(wǎng)工作室 責(zé)任編輯:蔣曉涵 夏郗 】